EU Medical Device Regulation

의료기기 인증 EU MDR(Medical Device Regulation)은 2021년 5월 26일부로 EU의
의료기기 지침 (MDD, 93/42/EEC) 및 지침 90/385/EEC(활성 이식형 의료기기-AIMDD)을
대체하게 되었습니다.의료기기 인증 EU MDR은 EU의 기존 지침과 몇 가지 중요한 차이가
있습니다.
TÜV NORD는 전문 엔지니어들과 함께 다수의 프로젝트를 통해 의료기기 분야의 높은
역량과 경쟁력을 갖추고 있습니다. TÜV NORD는 프로세스를 준수하여 전문적이고 체계적인
서비스를 제공합니다.
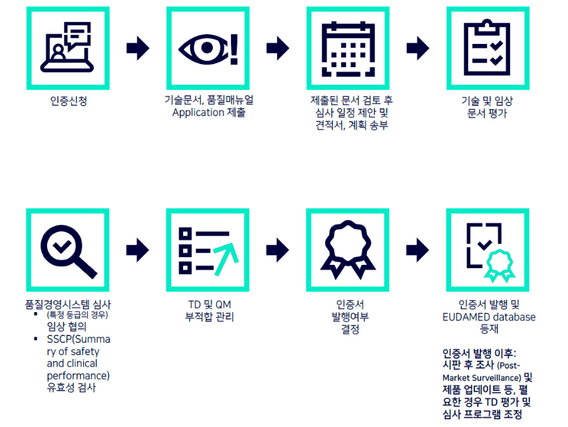
EU MDR 인증서 발행 프로세스
EU MDR은 "Medical Device Regulation"의 약자로, 유럽에서 2017년 채택된 의료기기
규정입니다. 의료기기 제조업체가 제품을 개발, 생산 및 판매할 때 따라야 하는 규정으로,
제품의 안전성과 성능을 보장하고 환자 및 의료진의 안전을 보호하는 것이 목적입니다.
EU MDR은 2021년 5월 26일부터 시행되었습니다.
의료 장치 규정은 의료 장치의 안전 및 성능에 대한 요구 사항과 의료 장치의 개발,
제조 및 시장 배치를 관리하는 품질 시스템에 대한 요구 사항을 규정합니다.
의료기기는 다양한 종류가 있으며, 예를 들어 의료용 시술기구, 진단용 기기, 치료용
기기, 재활용품, 혈액 관련 기기 등이 있습니다.
따라서 EU MDR은 모든 종류의 의료기기에 적용됩니다.
EU MDR은 2021년 5월 26일부터 기존의 유럽 지침을 대체했습니다.
이는 유럽 시장에서 의료 기기를 관리하는 유일한 규정이라는 것을 의미합니다. 의료기기
제조업체가 여전히 유효한 인증서를 보유하고 있는 일부에 대해서는 예외가 적용됩니다.
의료기기는 큰 변화가 없는 전제하에, 2024년 5월 26일까지 EU MDR 인증없이 출시될 수
있으며, 그 후로는 EU MDR 인증이 필수입니다.
25년에 걸쳐 의료 기기, 기술과 관련하여 법원이 채택한 방식에 대한 규정이 지속적으로
개발되고 변경되었습니다.이러한 점을 고려하여 의료 장치, 능동 이식형 장치 및 체외
진단에 관한 기존 유럽 지침을 재고의 필요성이 제기되었습니다.
새로운 의료기기 규정(EU MDR)의 제정은 유방암 관련 이슈에 의해 시작되었습니다.
이 새로운 규정은 앞으로 동일한 이슈가 재발하지 않도록 하기 위한 목적도 가지고
있습니다. 새로운 국가가 국내법으로 전환하여 시행할 필요가 없다는 장점이 있습니다.
그러므로 규정은 모두 일괄적으로 통일되어 해석되며, 제조업체가 현재 공개된 형식으로
직접 사용할 수 있음을 의미합니다.
European Commission / Nando (TÜV NORD CERT Notified Body) und Designation scope
ZLG (Zentralstelle der Länder für Gesundheitsschutz bei Arzneimitteln und Medizinprodukten)
MDCG (Guidance - MDCG endorsed documents and other guidance)
EUDAMED (European Database on Medical Devices)
Certification (EU) 2017/745 Medical Devices Regulation (MDR)